PHÒNG GD & ĐT HUYỆN GIA LỘC
| ĐỀ THI HỌC SINH GIỎI LỚP 9 MÔN: HÓA HỌC Thời gian làm bài 150 phút (Đề này gồm 05 câu 01 trang) |
Câu 1( 2 điểm):
1. Dẫn khí H2 dư đi qua hỗn hợp A gồm Fe2O3, Al2O3, MgO nung nóng, sau phản ứng thu được hỗn hợp rắn B. Cho hỗn hợp B vào dung dịch NaOH dư, sau phản ứng hoàn toàn thu được dung dịch C và rắn D. Sục khí CO2 dư vào dung dịch C thì được kết tủa E. Cho rắn D vào dung dịch H2SO4 đặc, nóng dư thì được khí F mùi hắc. Viết các phương trình hóa học xảy ra và xác định thành phần A, B, C, D, E, F.
2. Nêu hiện tượng và viết phương trình hóa học xảy ra:
a) Cho mẩu Na vào dung dịch FeCl3
b) Nhỏ dung dịch Ca(HCO3)2 vào dung dịch chứa Ba(OH)2
Câu 2( 2 điểm):
1. Chỉ dùng thêm quỳ tím, em hãy phân biệt các dung dịch bị mất nhãn sau: H2SO4, NaCl, HCl, MgCl2, Ba(OH)2.
2. Hòa tan hoàn toàn 5 gam CuSO4.5H2O bằng 45 gam dung dịch CuSO4 10% thì được dung dịch CuSO4 bão hòa ở nhiệt độ t0C. Tính độ tan của CuSO4 ở t0C.
Câu 3( 2 điểm): 
1. Trong phòng thí nghiệm để điều chế khí SO2 người ta sử dụng bộ dụng cụ như hình vẽ a. Em hãy cho biết dung dịch X , chất rắn Y thuộc loại chất gì và viết một phương trình hóa học minh họa? b. Bông tẩm dung dịch NaOH có vai trò gì và có thể thay bông tẩm dung dịch NaOH bằng nút cao su được không? Hãy giải thích.
|  
|
2. Cho một lượng kim loại M tác dụng vừa đủ với dung dịch H2SO4 10%, sau phản ứng thu được dung dịch muối có nồng độ 11,98 %. Xác định tên và kí hiệu của kim loại trên.
Câu 4( 2 điểm):
1. Em hãy trình bày phương pháp làm sạch khí CO2 có lẫn CO, SO2, SO3.
2. Dung dịch A là NaOH. Dung dịch B là HCl. Cho 200 gam dung dịch A vào cốc chứa 160 ml dung dịch B, tạo ra dung dịch chỉ chứa một chất tan. Cô cạn dung dịch thu được 18,9 gam chất rắn C. Nung rắn C đến khối lượng không đổi thu được thì còn lại 11,7 gam chất rắn. Tìm nồng độ phần trăm của dung dịch A và công thức của Z.
Câu 5( 2 điểm):
1. Sục từ từ V lít CO2 vào dung dịch có chứa 0,4 mol Ca(OH)2. Hãy tính khối lượng kết tủa thu được biết 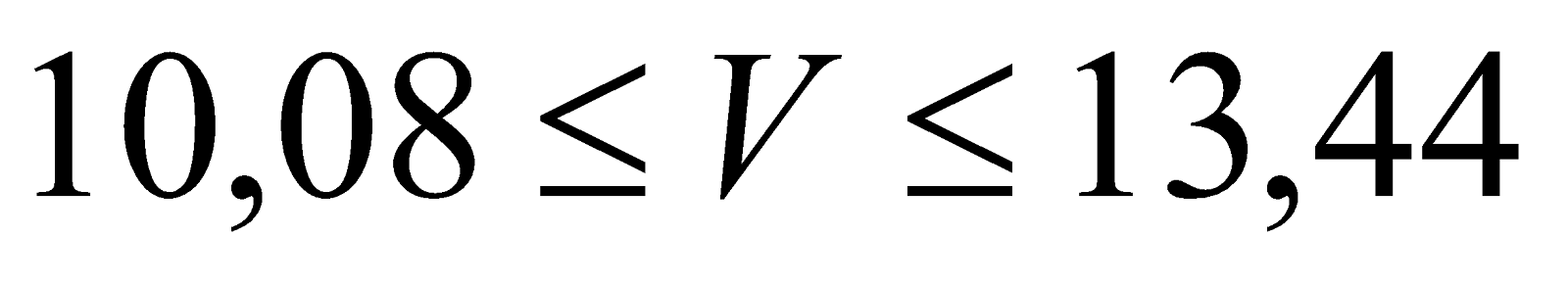 .
.
2. Khử hỗn hợp A gồm CuO và FeO bằng khí CO sau một thời gian thu được 14,4 gam hỗn hợp rắn B (gồm 4 chất) và thoát ra 4,48 lít khí C (đktc) có tỷ khối so với oxi là 1,125. Hòa tan hoàn toàn B bằng 52 gam dung dịch H2SO4 98% nóng, đến khi phản ứng kết thúc thu được V lít khí SO2 (đktc) và dung dịch D chỉ chứa Fe2(SO4)3 và CuSO4.. Tính khối mỗi oxit trong hỗn hợp A.
PHÒNG GD & ĐT HUYỆN GIA LỘC
| HƯỚNG DẪN CHẤM ĐỀ THI HỌC SINH GIỎI LỚP 9 MÔN: HÓA HỌC Thời gian làm bài 150 phút (Đề này gồm 05 câu 01 trang) |
Câu | Ý | Hướng dẫn chấm | Biểu điểm |
1 | 1 | - Dẫn khí H2 dư đi qua hỗn hợp A. 4H2 + Fe3O4 3Fe + 4H2O 3Fe + 4H2O Rắn B gồm: Fe, Al2O3, MgO - Cho hỗn hợp B vào dung dịch NaOH dư Al2O3 + 2NaOH  2NaAlO2 + H2O 2NaAlO2 + H2O Dung dịch C chứa NaAlO2 và NaOH dư; rắn D gồm Fe, MgO - Sục khí CO2 dư vào dung dịch C CO2 + NaAlO2 + 2H2O  Al(OH)3 + NaHCO3 Al(OH)3 + NaHCO3 CO2 + NaOH  NaHCO3 NaHCO3 Kết tủa E là Al(OH)3 - Cho rắn D vào dung dịch H2SO4 đặc, nóng dư 2Fe + 6H2SO4  Fe2(SO4)3 + 3SO2 + 6H2O Fe2(SO4)3 + 3SO2 + 6H2O MgO + H2SO4  MgSO4 + H2O MgSO4 + H2O Khí F là SO2. |
0,25
0,25
0,25
0,25 |
2 | a) Mẩu Na tan dần có khí không màu không mùi thoát ra và xuất hiện kết tủa màu nâu đỏ 2Na + 2H2O  2NaOH + H2 2NaOH + H2 3NaOH + FeCl3  3NaCl + Fe(OH)3 3NaCl + Fe(OH)3 b) Xuất hiện kết tủa trắng Ca(HCO3)2 + Ba(OH)2  BaCO3 + CaCO3 + 2H2O BaCO3 + CaCO3 + 2H2O | 0,25
0,25
0,25 0,25 |
2 | 1 | Lấy mỗi dung dịch một ít làm các mẫu thử rồi đánh số thứ tự tương ứng - Cho lần lượt từng mẫu thử tác dụng với quỳ tím + Mẫu thử làm quỳ tím chuyển xanh là Ba(OH)2 + Mẫu thử làm quỳ tím chuyển đỏ là HCl; H2SO4 ( nhóm 1) + Mẫu thử không làm quỳ tím chuyển màu là MgCl2; NaCl (nhóm 2) - Cho Ba(OH)2 lần lượt tác dụng với từng mẫu thử nhóm 1 + Mẫu thử xuất hiện kết tủa là H2SO4 Ba(OH)2 + H2SO4  BaSO4 + 2HCl BaSO4 + 2HCl + Mẫu thử không xuất hiện kết tủa là HCl Ba(OH)2 + 2HCl  BaCl2 + 2H2O BaCl2 + 2H2O - Cho Ba(OH)2 lần lượt tác dụng với từng mẫu thử nhóm 2 + Mẫu thử xuất hiện kết tủa là Mg(OH)2 Ba(OH)2 + MgCl2  Mg(OH)2 + 2H2O Mg(OH)2 + 2H2O + Mẫu thử không hiện tượng gì là NaCl |
0,25
0,25
0,25
0,25 |
2 | 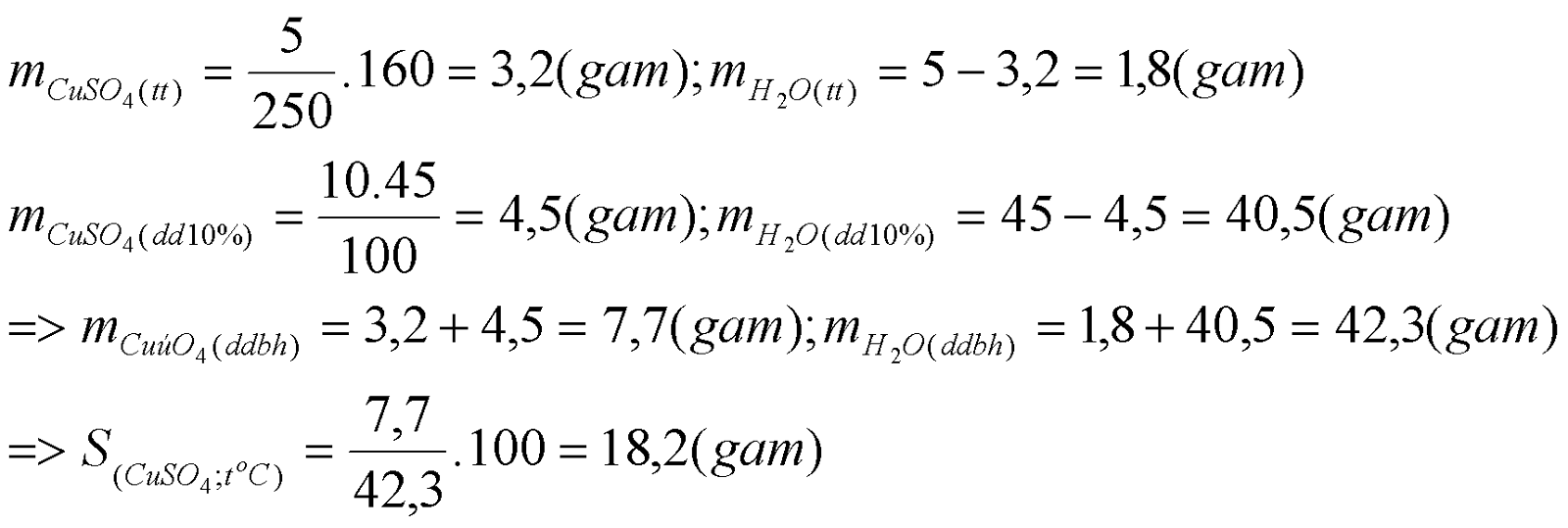
| 0,25
0,25
0,25
0,25 |
3 | 1 | a) - Dung dịch X là dung dịch axit mạnh: HCl, H2SO4 Rắn Y là các muối sunfit, muối hidrosunfit: NaHSO3, Na2SO3 NaHSO3 + HCl  NaCl + H2O + SO2 NaCl + H2O + SO2 b) - Bông tẩm dung dịch NaOH để ngăn SO2 độc thoát ra ngoài. Vì khí SO2 sẽ bị NaOH giữ lại theo phản ứng: SO2 + 2NaOH  Na2SO3 + H2O Na2SO3 + H2O - Không thể thay bông tẩm dung dịch NaOH bằng nút cao su vì như vậy sẽ không đẩy được không khí ra khỏi lọ. | 0,25
0,25
0,25
0,25 |
2 | Giả sử M có số mol là 2. 2M + xH2SO4  M2(SO4)x + xH2 M2(SO4)x + xH2 2 x 1 1 (mol) 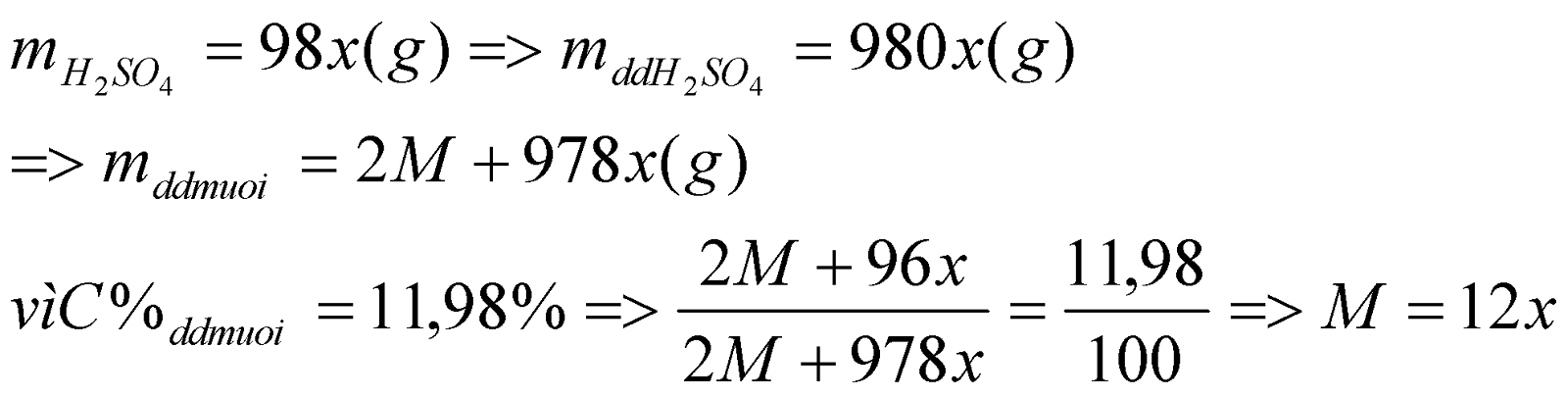
Vì x là hóa trị của kim loại M nên x có thể nhận các giá trị 1,2,3 Vậy ta có bảng giá trị x | 1 | 2 | 3 | M | 12( loại) | 24( Mg) | 36( loại) |
Vậy M là magie ( Mg) |
0,25
0,25
0,25
0,25
|
4 | 1 | Sục hỗn hợp khí vào dung dịch BaCl2 dư SO3 + H2O + BaCl2  BaSO4 + 2HCl BaSO4 + 2HCl Thu hỗn hợp khí thoát ra ( CO, SO2, CO2) rồi sục vào dung dịch Br2 dư SO2 + 2H2O + Br2  2HCl + H2SO4 2HCl + H2SO4 Sau phản ứng thu khí thoát ra (CO2, CO) sục vào dung dịch Ca(OH)2 dư, thu khí thoát ra đem làm khô ta được CO CO2 + Ca(OH)2  CaCO3 + H2O CaCO3 + H2O | 0,25
0,25
0,25
0,25 |
2 | Vì dung dịch chỉ chứa một chất tan nên dung dịch chỉ chứa chất tan là NaCl. Cô cạn dung dịch thu được 18,9 gam chất rắn C. Nung rắn C đến khối lượng không đổi thu được thì còn lại 11,7 gam chất rắn chứng tỏ C là muối ngậm nước NaCl.nH2O. 11,7 gam là khối lượng muối NaCl khan.=>  Vậy công thức của C là NaCl.2H2O. nNaCl = 11,7:58,5 = 0,2 (mol) NaOH + HCl  NaCl + H2O NaCl + H2O 0,2 0,2 0,2 (mol) => 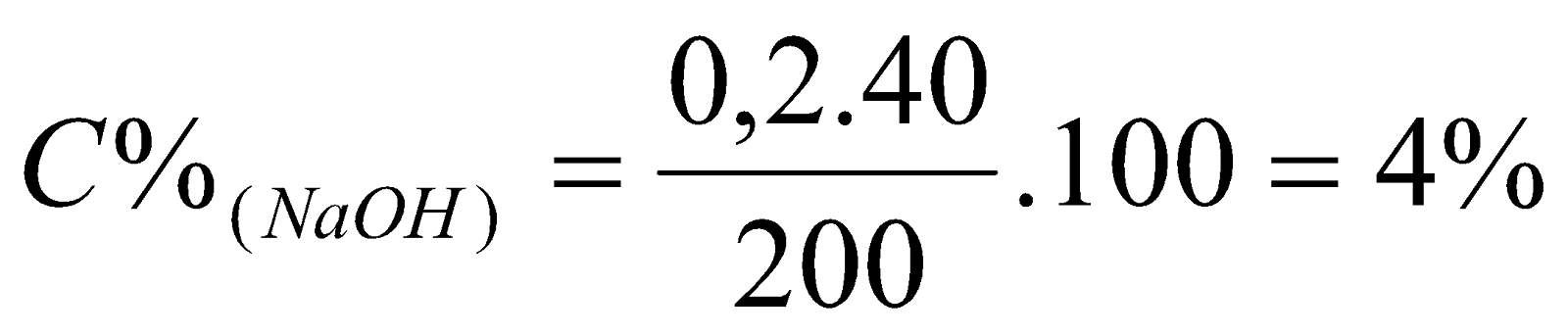
|
0,25
0,25
0,25
0,25
|
5 |
| 1. Ta có  Khi sục CO2 vào dung dịch Ca(OH)2 có thể sảy ra các phản ứng sau: CO2 + Ca(OH)2  CaCO3 + H2O (1) CaCO3 + H2O (1) x x x (mol) 2CO2 + Ca(OH)2 Ca(HCO3)2 (2) Ca(HCO3)2 (2) 2y y y (mol) - Để chỉ tạo muối trung hòa : CO2 + Ca(OH)2  CaCO3 + H2O CaCO3 + H2O 0,4 0,4 0,4 mol 0,4 0,4 mol =>  - Để chỉ tạo muối axit 2CO2 + Ca(OH)2 Ca(HCO3)2 Ca(HCO3)2 0,8 0,4 (mol) 0,4 (mol) =>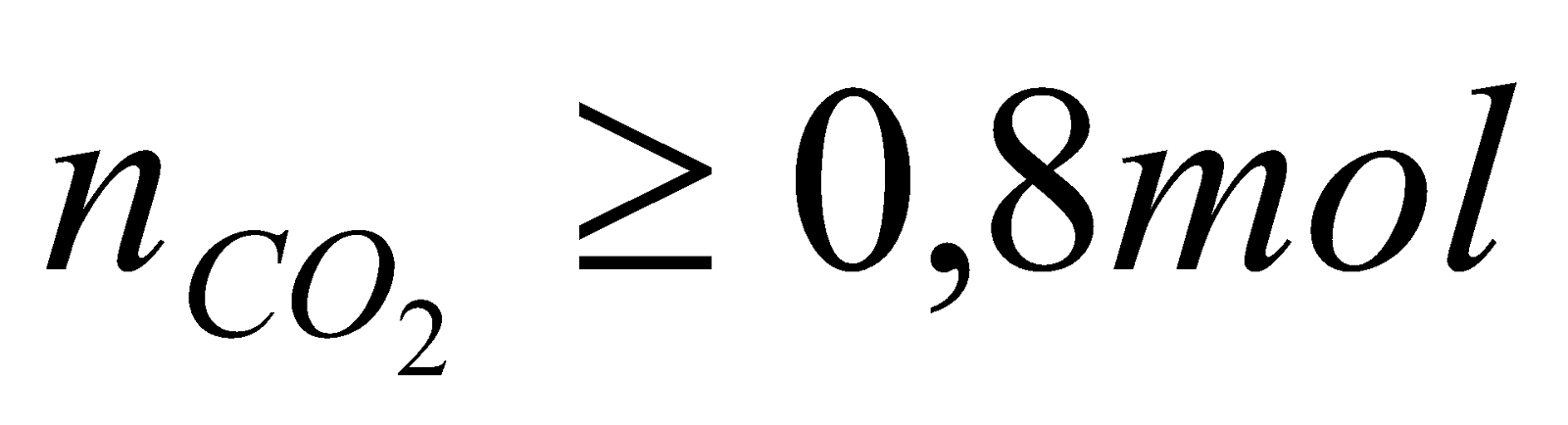 Vậy với  thì phản ứng sẽ tạo 2 muối và kết tủa sẽ giảm dần khi lượng CO2 tăng dần thì phản ứng sẽ tạo 2 muối và kết tủa sẽ giảm dần khi lượng CO2 tăng dần Gọi  * Khi 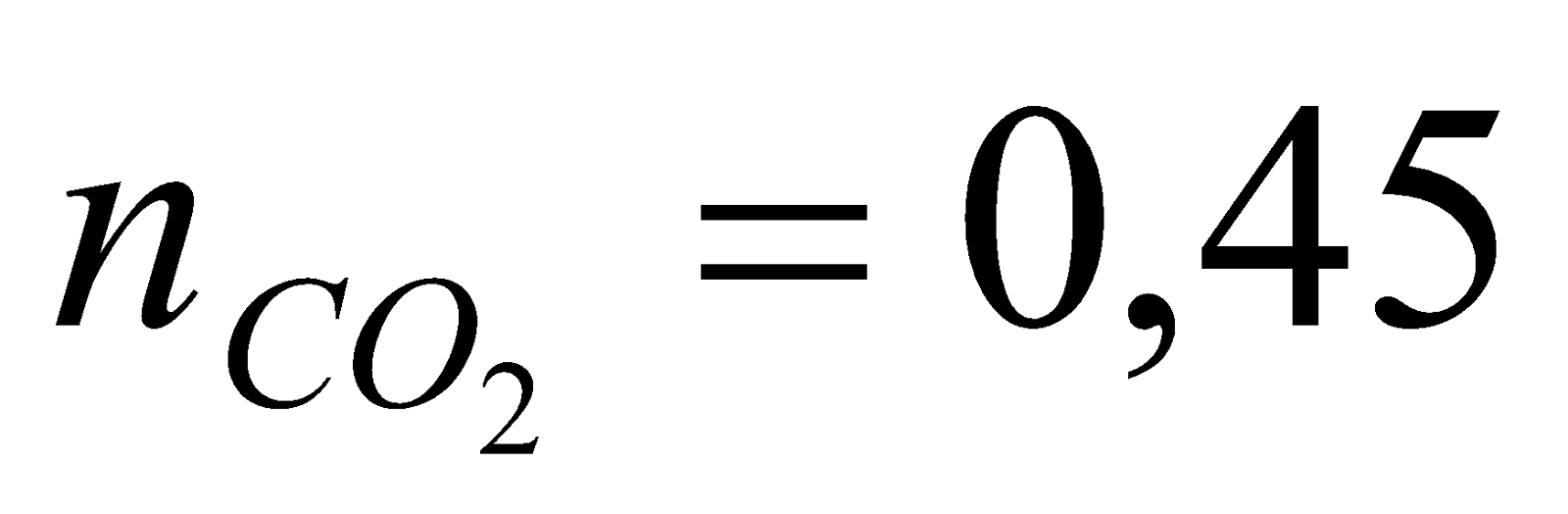 mol ta có hệ pt: mol ta có hệ pt: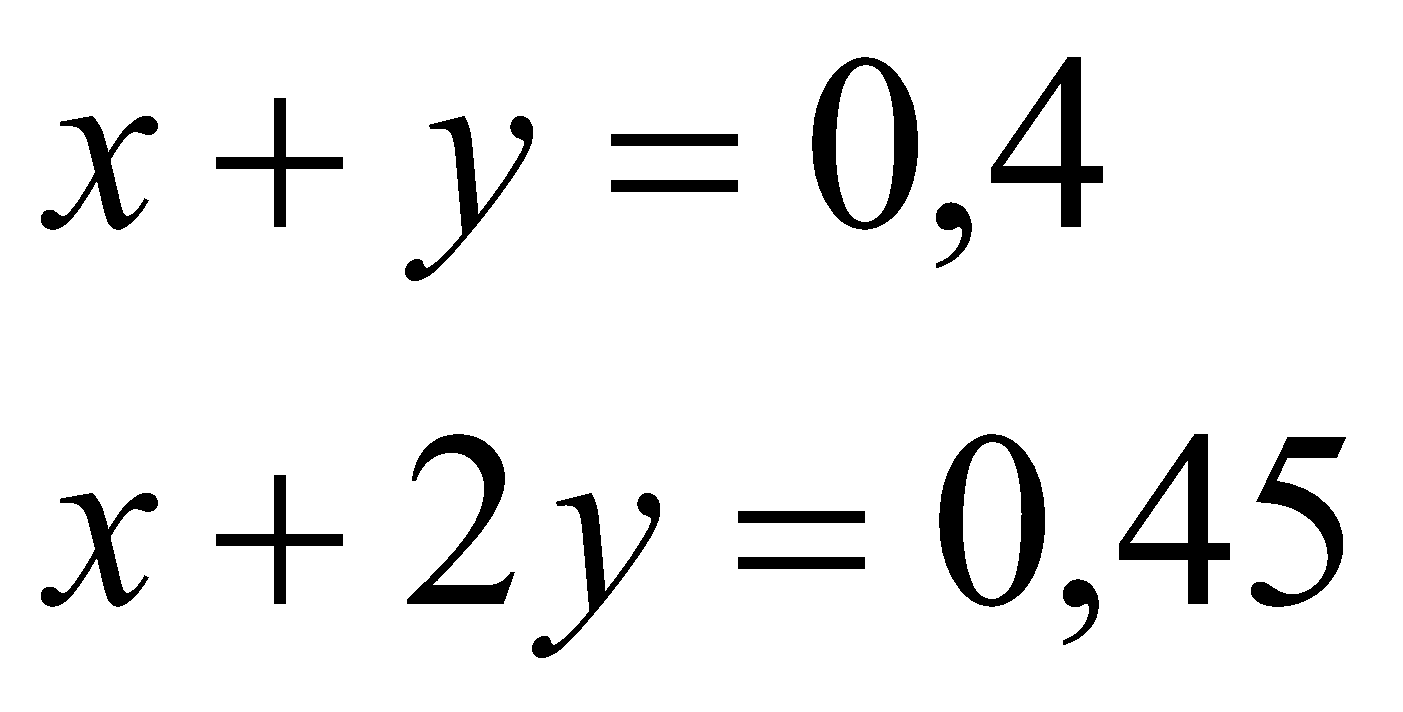 => x = 0,35; y = 0,05 => x = 0,35; y = 0,05
* Khi 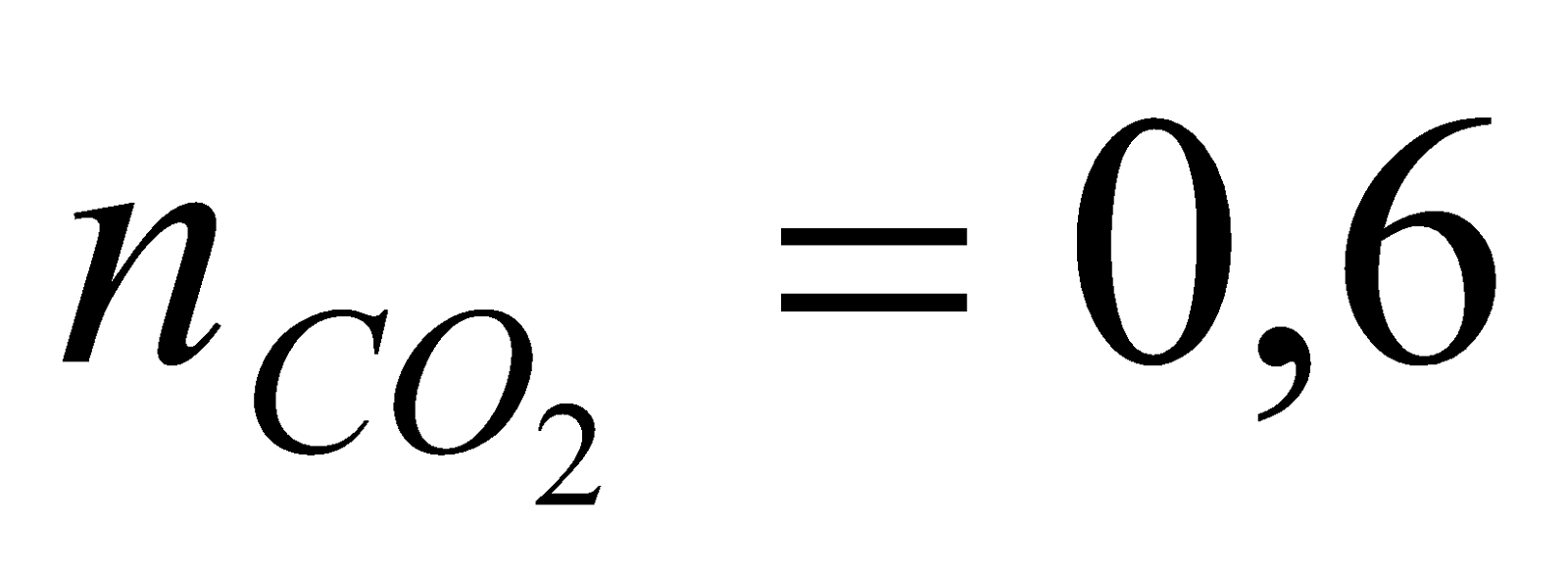 mol ta có hệ pt: mol ta có hệ pt: 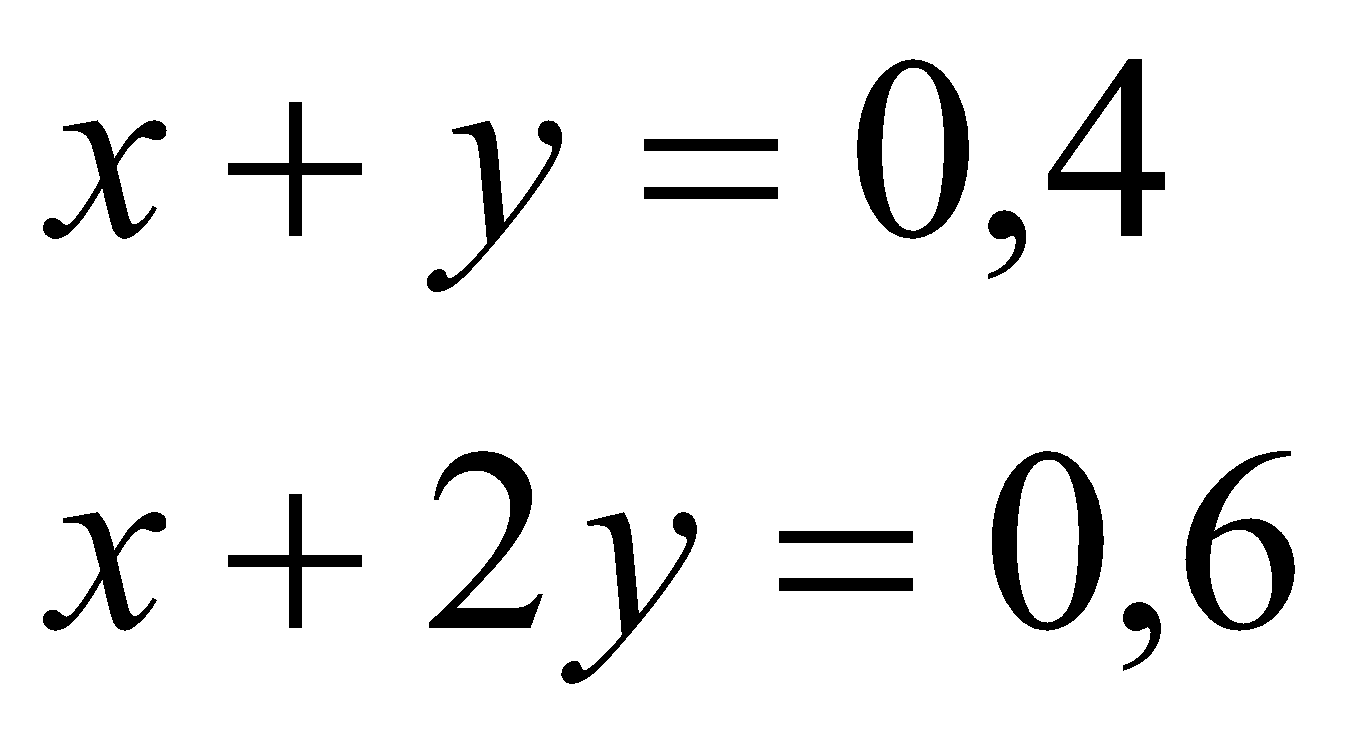 =>x= y = 0,2 =>x= y = 0,2 =>  2. * Khử hỗn hợp A ta có sơ đồ: A + CO 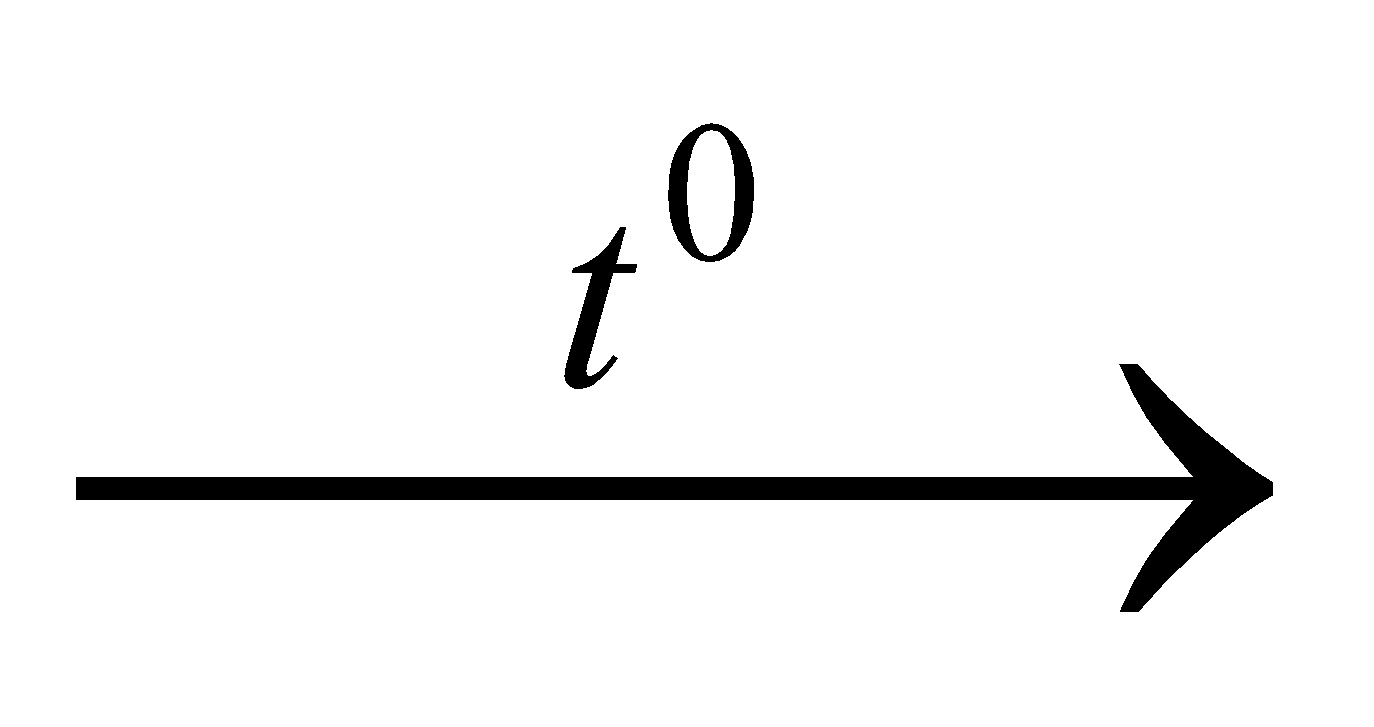 B + khí C (1) B + khí C (1)  => Khí C gồm CO và CO2 => Khí C gồm CO và CO2
nC = 4,48: 22,4 = 0,2 (mol) => mC = 36.0,2 = 7,2 (g) Theo bảo toàn mol C ta có: nCO(bđ) = nkhí C = 0,2 mol Áp dụng đlbt khối lượng ở (1) ta có: mA + mCO(bđ) = mB + mkhí C Hay mA + 0,2.28 = 14,4 + 7,2 => mA = 16 g Gọi số mol CuO và FeO trong A lần lượt là x, y (mol) => 80x + 72y = 16 (2) * Hòa tan hoàn toàn hỗn hợp B bằng H2SO4 đặc nóng ta có sơ đồ phản ứng: B + H2SO4 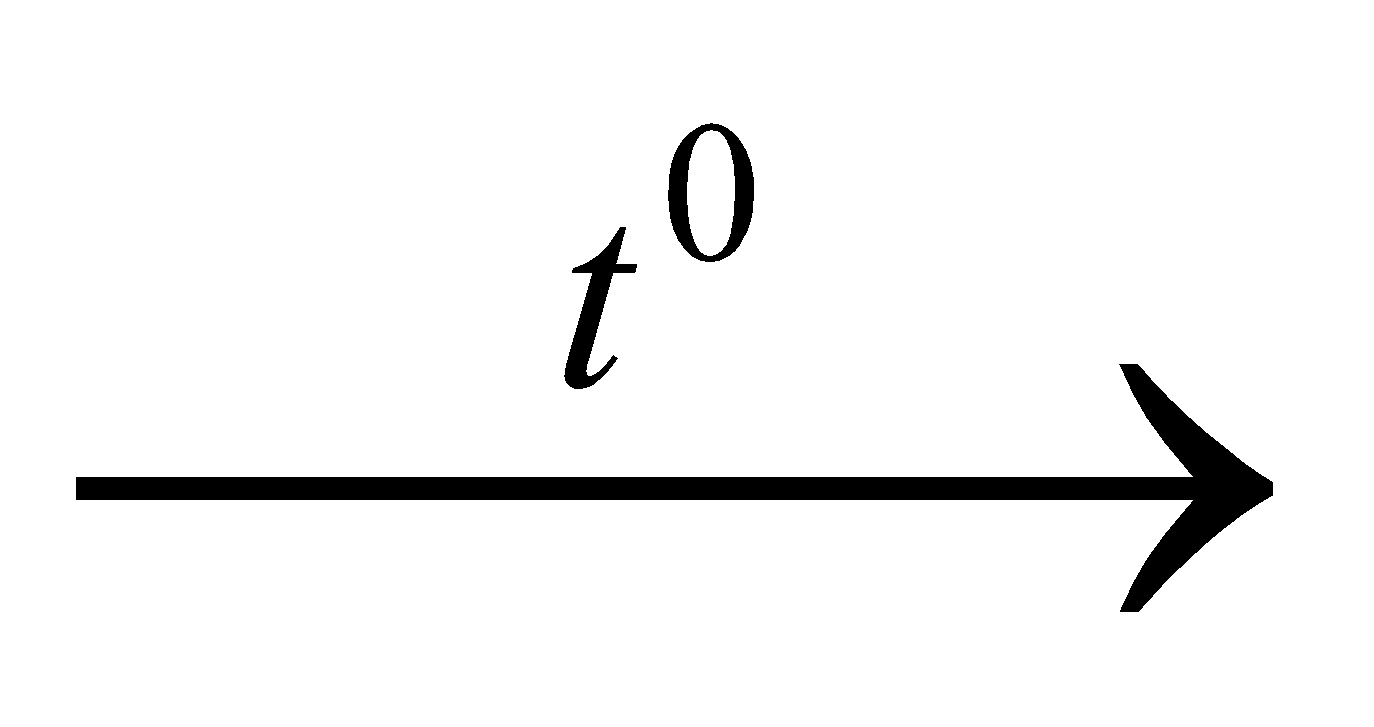 muối Fe2(SO4)3 + SO2 + H2O (3) muối Fe2(SO4)3 + SO2 + H2O (3) CuSO4 Theo bảo toàn mol Fe, Cu =>  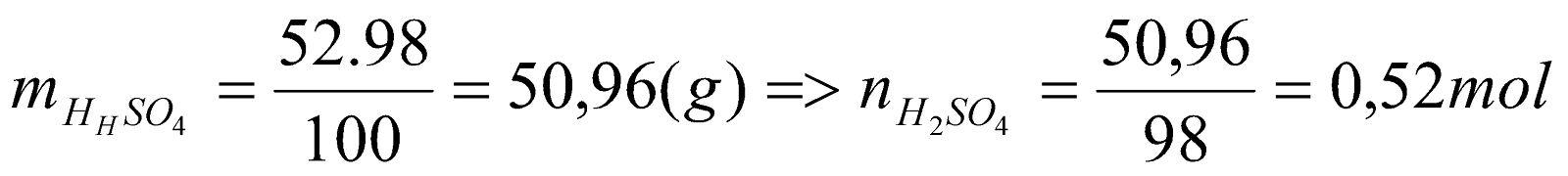
Theo bảo toàn mol S ta có: nS( trong SO2)= n(s trong axit) - nS( trong muối) => n(S trong SO2) = 0,52 - x - 1,5y (mol) Theo bảo toàn mol H =>   Áp dụng định luật bảo toàn cho sơ đồ 3 ta có: mB + maxit = mmuối +  =>14,4 + 50,96= 160x + 400.0,5y + (0,52 – x – 1,5y).64 + 0,52.18 => 96x + 104y = 22,72 (4) Kết hợp (2) và (4) giải ta được: x= 0,02; y = 0,2 =>mFeO = 0,2.72= 14,4 (gam) mCuO = 0,02.80 = 1,6 (gam) |
0,25
0,25
0,25
0,25
0,25 |